打算开个新的专题,讲讲我的final year project,这也算是我第一个实际意义上的research experience吧。做完final year project之后一直很想讲讲这个部分的内容,但又是final exam又是托福的,就一直没时间,到现在终于放假了就来写写吧,每天码几个字,持续更新hhhh:-) ——2023.12.23
首先是我final year project的题目——Investigation of the Apoptotic Effects of Metformin: Potential for Anti-cancer Drug Development (二甲双胍细胞凋亡效应的研究:潜在抗癌药物的研发)。
为什么选这个题目呢?因为当时就提供四个大的方向给我们选:1.Microbiology; 2. Cell and Cancer Biology; 3. Clinical Chemistry; 4. Molecular Technique。既是如此,我就想着选个挑战性高的(据说只给一瓶cell line,养死了project就玩完了),实验课中接触少的,多学一点是一点吧,嘿嘿,而且Cancer biology恰恰是我很感兴趣的方向。于是在我的怂恿下,另外三位内地生也选了这个topic,其他local的学生就没有人把这放first choice的😂。

点这看outline↑
在supervisor的建议下,题目就大致定为Investigation of the apoptotic effects of [synthesized drug/natural compound]: potential for anti-cancer drug development. 这其实算是挺热门的研究,就是把已有的其他病的合成药或者什么化合物拉过来,看它杀不杀癌细胞。如果确认其有抗癌性,最棒的情况甚至可以直接把这药用到癌症治疗上。而且!!因为这些药都已经上市了,毒性机理都很清楚,几乎不用临床试验(一般新药的临床试验都得数十年),简直是居家旅行,省时省力,省钱省心,必备良方😀
二甲双胍(Metformin),出了名的糖尿病药。我当时选二甲双胍这药也是挺意外的。我当时想既然要选个“也许有抗癌潜力的合成药”,总得先看看之前的相关研究吧。总不能找个和癌症机理八竿子打不着的药研究其抗癌性吧😂 于是几篇二甲双胍有可能具有抗癌潜力的论文映入眼帘。我想着,二甲双胍,这不是出了名的糖尿病药吗🤔 连我爷爷都知道,他每天要吃几粒二甲双胍。它具有抗癌性?不过确实有不少研究有表明。好了,那就它了,和癌症听上去没啥关系,但又似乎有抗癌性的,二甲双胍。
HT-29 cell line 和 CAL-1 cell line。这俩是本project所用的细胞系。一开始我想着要搞二甲双胍,那就找个听着很相关的胰腺癌的细胞系(pancreatic cancer cell line)吧。你听听,二甲双胍,糖尿病,胰腺,胰腺癌,看上去多相关啊😆 而且胰腺癌不是被称为癌症之王吗😏 但不巧了,胰腺癌细胞系比较少见,实验室刚好没有😳 Supervisor就将其换成HT-29 cell line,是一种结直肠癌细胞系(Colorectal cancer cell line)。后来想想,二甲双胍除了作用在肝,尤其是糖异生,也作用在肠呀,那肯定能有些关联的。有了癌细胞系(cancer cell line),在我强烈要求抗议下,supervisor只好又给了我正常细胞的细胞系(normal cell line),CAL-1,一种树突细胞的细胞系,作为对照组。
除了二甲双胍,我还用了一种已知的抗癌药作为阳性对照(positive control)——5-氟尿嘧啶(5-FU),这是出了名的化疗药,毒性极强,对结直肠癌有奇效,真可谓是杀人灭口,杀癌灭瘤,必备良药😀 用它作为阳性对照,比较二甲双胍的抗癌效果再适合不过了。看哪,这小小一瓶10g就要三百多美刀哩😇

好了,背景讲得差不多了,该开始讲正题了。balabala那么久还没开始讲我怎么做实验。。本想着按我论文的方法和结果讲,但想想还是按照实验的时间顺序讲吧,这样显得好玩又真实(bushi(其实就是单纯懒得再去翻论文🤣
一开始,我们每人各获得了一瓶HT-29细胞,大概长这样,HT-29细胞长成一层附着在底面上,然后浸在培养基里,如果细胞挂了就会浮在培养基里。当时已经传到第六代了。至于CAL-1细胞那是刚从-80℃解冻出来的,就从第一代开始传(CAL-1细胞不一样,不是附着在底部,而是浮在培养基里长的)。我们就先熟悉一下传代培养(sub-culture)的流程,于是。。短短一周内HT-29细胞就进入了第九代,变成四瓶(这样即使有瓶被污染挂了,其他还有三瓶哩,hhhh我真是冰雪聪明(bushi,←这人可能有什么大病,每瓶细胞那么少就强行传代


此乃RPMI1640培养基,专业培养细胞五十余年
细胞传代培养(cell sub-culture)的流程其实挺简单的,主要目的就是换一下培养基,让细胞吃得饱,睡得好
哎,这个反正就是让细胞健康快乐成长的方法啦,细胞如果都gg了还做个鬼实验。
细胞传代培养(cell sub-culture)的流程其实挺简单的,主要目的就是换一下培养基,让细胞吃得饱,睡得好
哎,这个反正就是让细胞健康快乐成长的方法啦,细胞如果都gg了还做个鬼实验。

此乃RPMI1640培养基,专业培养细胞五十余年
关于RPMI1640培养基,这里再补充几句。这里拿到这样一瓶的是基本培养基(basal medium)。但要培养细胞肯定是远远不够的,里面还得加点补充。一般里面会加胎牛血清(Fetal Bovine Serum, FBS)和抗生素(antibiotics,用的是青霉素+链霉素溶液,Penicillin-Streptomycin Solution)。胎牛血清含有生长因子(growth factor)和细胞因子(cytokine),这样细胞就能噌噌噌地长💨;抗生素呢就是防止细菌的污染。对HT-29细胞我是加了10%的FBS和1%的antibiotics;对CAL-1我还加了HEPES和2-Mercaptoethnol分别用来调pH和抗氧化。


CAL-1细胞培养基配方
讲完怎么培养细胞,就该讲讲怎么拿细胞做实验了。
首先,细胞从培养基取出来后是以细胞悬液(cell suspension)的形式存在的,就是一管培养基里面漂着细胞🧪 那第一个遇到的问题就是这管悬液大概有多少细胞,即细胞密度(cell density)。如何确定细胞密度呢,总不能拿显微镜一个一个数吧,这一管细胞少说几百万甚至可能几亿个😂 但真就是拿显微镜数的,不过是有方法的——台盼蓝排斥试验(trypan blue exclusion test)。先取一小点细胞悬液出来,我习惯是取20μl,然后加等量的台盼蓝(这样比较好算,数完乘2就行),接着把它打到血细胞计数板(hemocytometer)里面,放显微镜数就能大致估计了。
血细胞计数板我记得好像高中生物有讲过,大概就如图所示,显微镜下看就是一堆格子。这玩意的规格是全球统一的,标1234的这几个正方形边长为1mm,各处的厚度都是0.1mm,所以这每个大正方形所对应的体积为0.1μl。我一般就数1234每个正方形里细胞的数量,取个平均,换算下单位,乘稀释倍数,就能算出每毫升悬液大概多少细胞了。公式如下:cell density (n/ml) = [(n1+n2+n3+n4)/4] × 104 × 2。104是因为1ml = 0.1μl × 104,2是因为我加了等量台盼蓝稀释。(怎么感觉越说越复杂🤣,反正数完套公式就是了(*^_^*)
既然是用血细胞计数板数的,那细胞悬液直接打到计数板不一样能数吗,为啥要加台盼蓝?确实能数,但问题是分辨不出死细胞。台盼蓝可以穿透死细胞的细胞膜,把细胞染成蓝色,但活细胞就不会被染。如图,你能看到活细胞,一个个跟泡泡似的,但还是能看到一两个染成蓝的死细胞。那数的时候当然不能数死细胞了😗 这就是为什么这方法叫exclusion test,就是把死细胞exclude了。

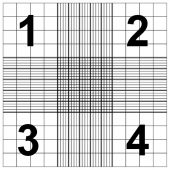

首先,细胞从培养基取出来后是以细胞悬液(cell suspension)的形式存在的,就是一管培养基里面漂着细胞。那第一个遇到的问题就是这管悬液大概有多少细胞,即细胞密度(cell density)。如何确定细胞密度呢,总不能拿显微镜一个一个数吧,这一管细胞少说几百万甚至可能几亿个

血细胞计数板我记得好像高中生物有讲过,大概就如图所示,显微镜下看就是一堆格子。这玩意的规格是全球统一的,标1234的这几个正方形边长为1mm,各处的厚度都是0.1mm,所以这每个大正方形所对应的体积为0.1μl。我一般就数1234每个正方形里细胞的数量,取个平均,换算下单位,乘稀释倍数,就能算出每毫升悬液大概多少细胞了。公式如下:cell density (n/ml) = [(n1+n2+n3+n4)/4] × 104 × 2。104是因为1ml = 0.1μl × 104,2是因为我加了等量台盼蓝稀释。(怎么感觉越说越复杂
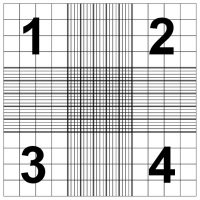
既然是用血细胞计数板数的,那细胞悬液直接打到计数板不一样能数吗,为啥要加台盼蓝?确实能数,但问题是分辨不出死细胞。台盼蓝可以穿透死细胞的细胞膜,把细胞染成蓝色,但活细胞就不会被染。如图,你能看到活细胞,一个个跟泡泡似的,但还是能看到一两个染成蓝的死细胞。那数的时候当然不能数死细胞了

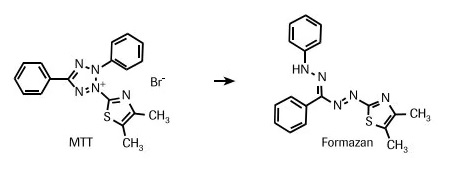
MTT试验(MTT assay)或MTS试验,这玩意儿应该叫细胞存活率分析(cell viability test)。原理大概就是活细胞里线粒体上的琥珀酸脱氢酶和细胞色素C还有活性,会把四唑(tetrazolium)还原成紫色的甲䐶(formazan),然后测一下吸光度(absorbance)就大概知道细胞存活的水平了。MTS试验也是差不多的原理,但操作上比传统的MTT简单好多,只要往细胞里加MTS溶液,培养个三四小时测吸光度就行了。细胞存活率越高,颜色越深,吸光度越高。细胞存活率的计算就用实验组的吸光度除空白对照的吸光度就行了。

此乃96 well plate,中文应该是叫96孔板吧
MTS试验的具体实验操作就是先把细胞接种到96孔板上,加药,培养24或48或72小时,拿出来加MTS溶液,过个三四小时测吸光率。←听上去灰常简单的亚子😂 但具体实验操作时各种问题一股脑地涌来😅 每个孔细胞要加多少?加药的浓度多少?药要用什么溶解?加药之后细胞密度是不是被稀释了?药加到细胞培养基里浓度是不是也被稀释了?要培养24还是48还是72小时?……
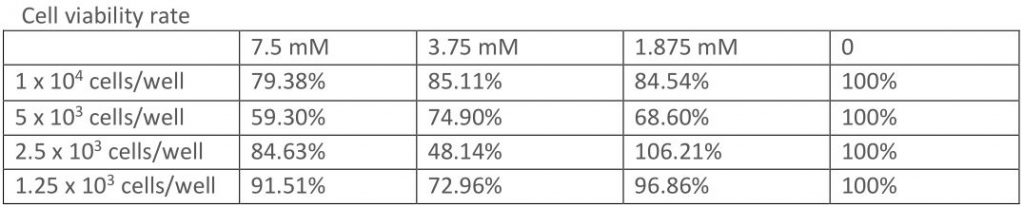
- 先解决第一个问题“每个孔细胞要加多少?”,Protocol上建议的范围是1×103 – 1×105 cell/well,但这范围还是有点太广了,怎么办,做实验呗😗 我梯度稀释出来了4个细胞密度1×105, 5×104, 2.5×104, 1.25×104 cell/ml,取100μl加到孔里,那细胞密度就分别是1×104, 5×103, 2.5×103, 1.25×103 cell/well了。先拿这几个细胞密度做实验,选出效果最好的,之后沿用就行嘿嘿。
- 至于“加药的浓度多少?”,我先拿先前研究论文上的浓度试试,之后反正得扩大范围的,于是我经计算第一次实验设置了15mM, 7.5mM, 3.75mM, 和0mM四组浓度的二甲双胍。
- 我第一次是用蒸馏水溶解的药(但后来想想,细胞这次没被我搞死可真是命大😇,“药要用什么溶解”的问题之后确实困扰了我好久。
- 因为细胞密度是按每个孔多少细胞算的,加药之后每个孔还是那么多细胞,没变。
- 药加到培养基里当然被稀释了,所以实验前计算一定得考虑周全🤣
- 开局先快速积累点数据,所以首选24小时,之后没啥效果再延长时间咯
于是第一次MTS试验开始了,其实这才实验的第二天就赶鸭子上架了

看这实验操作,主打一个浪费板子😅
正常来讲药的浓度越高,细胞会死得越多,但如果细胞密度太高或太低就会很不准,甚至没有这个趋势。如上表,数据比较完美的就只有1×104, 5×103 cell/well两个细胞密度。所以我就选择1×104 cell/well,之后的MTS全用这个细胞密度了,主要是数字整10比较好配hhhh
第一周就做了这一次MTS,结果一般般,算是有拿到数据但有些瑕疵的实验🤔,不过实验流程算是熟悉了。经过各种养精蓄锐,培养细胞,准备第二周好好再做几次MTS。
第二周经过一番整顿,吸取经验,准备大干一场😏 因为正常细胞CAL-1的密度还不太够,所以实验就集中在HT-29细胞上。我扩大药物浓度范围,设置了6.25mM, 12.5mM, 25mM, 50mM四个浓度,这次二甲双胍和5-FU都做。至于药物溶解嘛,我想了想用了PBS溶液🤣(就是这一举动导致这次MTS废了)PBS是一种缓冲液,主要成分就Na2HPO4,KH2PO4,NaCl之类的,洗细胞的时候一般用PBS溶液洗,我认为应该对细胞无害吧🙃,结果…… (摆上点实验数据瞧瞧吧
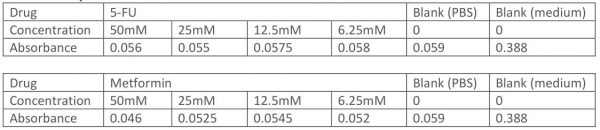

细胞除了那组啥都没加的空白对照,其他全死了。。只加PBS溶液的空白对照也死了(还好我当时多做了这组,算是揪出了原因。从这次MTS得到一个大大的教训:溶药就不能用PBS溶🤯!这组MTS算是废了,后面只能再重做了😓
于是当天我又准备了另一组MTS,这一次我准备了五个浓度,50mM, 25mM, 12.5mM, 20μM, 10μM。为什么突然冒出来两个那么低的浓度呢😶 因为现在不但做二甲双胍,也做5-FU了呀,据研究5-FU太毒了,差不多几十μM,细胞就死翘翘了,所以多做两组作为对照😬 那这次我用什么溶药呢?DMSO溶液(二甲基亚砜),说是无色无味无毒的有机溶剂,用来溶药应该挺合适的~
于是又等了一天,终于在第二周的周三等来了结果🧐
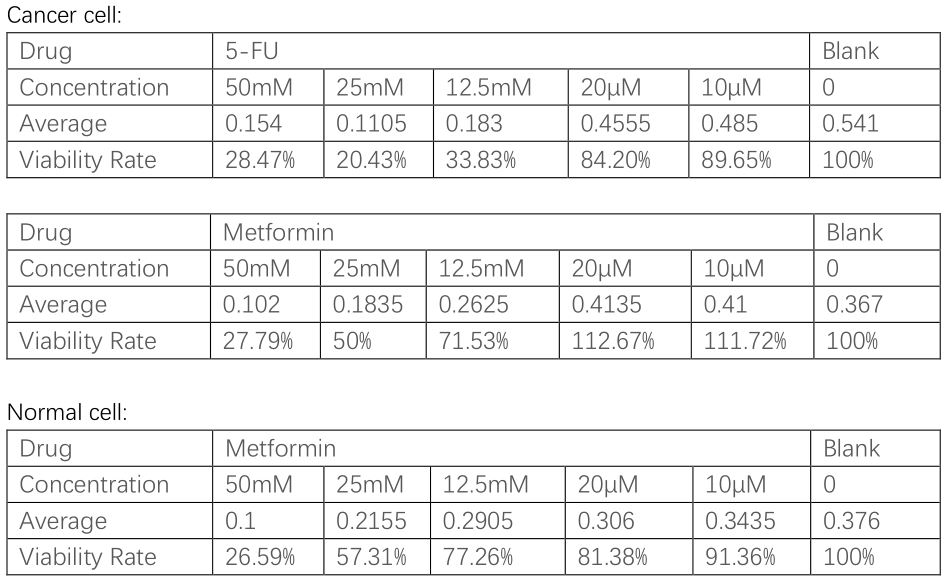
这结果应该不错,可以看出5-FU对癌细胞毒多了,对细胞一通咔咔乱杀,连那么低的浓度(10μM, 20μM)也有趋势;高浓度(50mM)的二甲双胍其实也不赖,不但癌细胞,连正常细胞也噶了😅
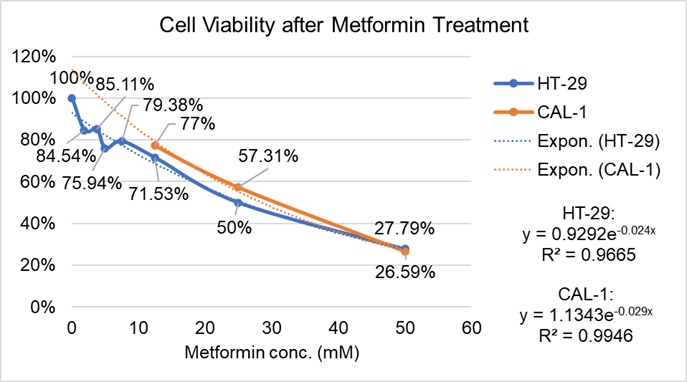
我把这次二甲双胍的数据和第一次MTS的数据整合了一下,得到了一张图表🤓 这张图我太喜欢了,简直奠定了我后面两周的实验思路。
如图可见,二甲双胍对HT-29细胞的IC50值应该在25mM,就是当二甲双胍浓度为25mM时HT-29细胞能死一半。但这浓度下正常细胞CAL-1也挂了快一半😅 所以后面的实验二甲双胍的浓度应该控制在10mM以内,不然正常细胞都挂了🥺。。但问题是小于10mM时,癌细胞HT-29它不死啊,存活率还有七八成🤣 点算啊。。。那就进行战略转移——延长时间,“以时间换空间”。24小时不死,就48小时、72小时,到时候只要CAL-1活得多,HT-29死得多就行了😎 我就不信延长时间HT-29还不死嘿嘿
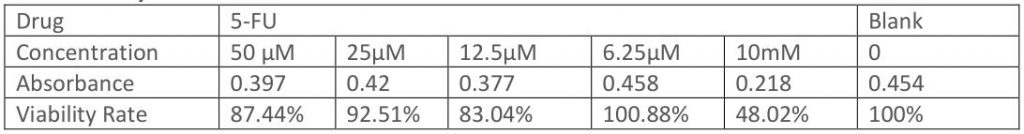
其实我周三的时候又准备了一组MTS,周四得到结果,这组是针对低浓度的,主要是为了选取个合适的5-FU浓度。理论上50μl的5-FU已经非常毒了,但看结果细胞居然还有87.44%的存活率😲 但不管了,后面的流式细胞术的5-FU还是照50μM加。
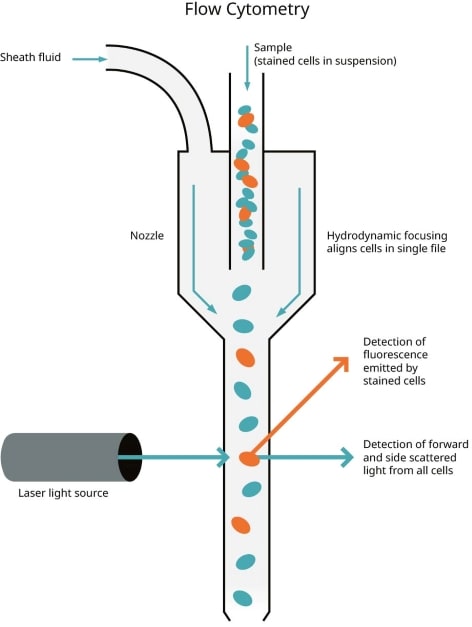
第二周还剩两天,我安排了另一个实验——流式细胞术(flow cytometry),用这技术来检测细胞究竟是凋亡(apoptosis)还是坏死(necrosis)(凋亡和坏死的区别,不懂的自己百度🤪)原本预定了周四的流式细胞仪(flow cytometer),但没想到第二组MTS废了,只能拖一下改成周五了,但也算是在这周先熟悉一下流程。
流式细胞术(flow cytometry),这玩意儿我想生物人应该都很熟悉。简单来说就是细胞一个一个这样流下来,然后有激光这样照每个细胞,然后根据散射的光用来确定每个细胞的特性😗 现在这技术已经发展到可以测量细胞的各种特性了,体积形态,DNA,RNA,蛋白质,表面抗原,细胞凋亡……甚至不是细胞都行,只要你想得到的,没有他办不到的,简直是生物研究的神兵利器⚔️
比较常见的用法就是给要检测的目标染色,让其接上个荧光基团,就相当于做记号📌 然后拿去流式细胞仪跑一下,有做记号的就通过散射的光检测出来了,附带的程序还能帮你算出有多少细胞有记号的,顺带连图都给你画出来😏

此乃实验室的流式细胞仪,已为CityU辛劳工作八九年👍

此乃Annexin V-FITC & PI Apoptosis Detection Kit,里面就500µl膜联蛋白V,500μl PI,一小瓶缓冲液。一袋不用998,不用888,只用710美刀🤑
我要检测的细胞凋亡,所以我用的是Annexin V-FITC & PI Apoptosis Detection Kit(膜联蛋白V连FITC和碘化丙啶细胞凋亡检测盒,中文读得真不顺口🤣)
活细胞的细胞膜内面有种东东叫PS(Phosphatidylserine,磷脂酰丝氨酸),这玩意在细胞凋亡早期的时候会从膜的内面给移出来。而膜联蛋白V(插嘴一句,这个念“膜联蛋白五”),恰恰能连到PS上;所以这时候用一个连着荧光基团FITC的膜联蛋白V就能检测细胞是否到了凋亡阶段了😗
但单单连着荧光基团的膜联蛋白V还只能检测细胞挂没挂,这时候再加上PI(propidium iodide,碘化丙啶)就能进一步区分凋亡和坏死了。PI能够染细胞的DNA🧬,但如果细胞还活着PI穿透不了细胞膜,染不了DNA;只有当细胞处于凋亡后期,或者坏死了,细胞膜破了,才有可能染到。
所以,膜联蛋白V阴,PI阴→细胞活着;膜联蛋白V阳,PI阴→凋亡早期;膜联蛋白V阳,PI阳→凋亡晚期或坏死;膜联蛋白V阴,PI阳→坏死。(嗯~ o(* ̄▽ ̄*)o 反正都阴就是活着,🐏了就是要挂或者挂了😇
流式细胞术需要有一定量的细胞,96孔板太小了不够,一般是把细胞种到培养皿里然后加药培养。Supervisor给了我们一神器,6 well plate,相当于一块板上有六个小培养皿。
我沿用96孔板的思路,但体积给它扩大十倍,所以每个坑中放1×105个细胞。药的浓度呢,就按MTS的结果,选取了10mM二甲双胍和50μM 5-FU。
具体的实验操作就是细胞加到六坑板,药加到六坑板,培养个24小时(或48或72),然后收割(harvest, 这词用得太妙了),就是把这个坑里无论活细胞死细胞全都洗出来,洗一洗,涮一涮,加膜联蛋白V和PI和缓冲液,之后就能跑流式细胞仪了😗
此乃6 well plate,中文管它叫六孔板我觉得不太恰当了,我提议应该叫六坑板😆
这六坑板我自己没拍照,找同学借的图👀
流式细胞术需要有一定量的细胞,96孔板太小了不够,一般是把细胞种到培养皿里然后加药培养。Supervisor给了我们一神器,6 well plate,相当于一块板上有六个小培养皿。

此乃6 well plate,中文管它叫六孔板我觉得不太恰当了,我提议应该叫六坑板😆
这六坑板我自己没拍照,找同学借的图👀
我沿用96孔板的思路,但体积给它扩大十倍,所以每个坑中放1×105个细胞。药的浓度呢,就按MTS的结果,选取了10mM二甲双胍和50μM 5-FU。
具体的实验操作就是细胞加到六坑板,药加到六坑板,培养个24小时(或48或72),然后收割(harvest, 这词用得太妙了),就是把这个坑里无论活细胞死细胞全都洗出来,洗一洗,涮一涮,加膜联蛋白V和PI和缓冲液,之后就能跑流式细胞仪了
这操作流程听着简单,其实做起来繁琐得要命🙃 六坑板拿出来,要吸出旧培养基把死细胞离心分离出来,然后再用PBS洗一遍,再分离;活细胞又要用胰蛋白酶脱离,然后再离心分离出来,用完胰蛋白酶又要洗;板上残留的细胞还要再洗洗,再离心分离出来,怕洗不干净,再洗洗,再分离…… md,一个板六个坑,每个坑都这么操作,要收割到猴年马月啊😵
在收割细胞之前我自己又多加了一步——用显微镜检测细胞形态。加这步能让我论文多不少字哩😂 细胞在板里或在瓶里普通光学显微镜肯定是看不了的,所以用的是倒置显微镜(inverted microscope)。实验室有台公用的,还连着软件可以抓拍,我就每个坑都拍了一下。
这玩意儿其实功能强大,荧光啥的都拍(这其实是他的本职工作😂),现在想想,我当时怎么没想到染完之后用它拍荧光呢。。这样论文又能多好多内容🤨 当时只顾着做流式细胞术了

倒置显微镜大概长这样,实验室里的还连着台平板,能抓拍看到的图像📸
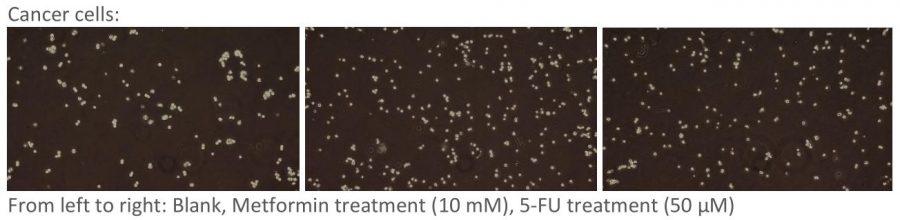
这是第一次细胞形态检测的实验结果,你可能会说,这也妹看出什么区别啊🙄 而且怎么看着空白对照的细胞好像还更少了。。这就对了,因为这次流式细胞术结果也是废的😅
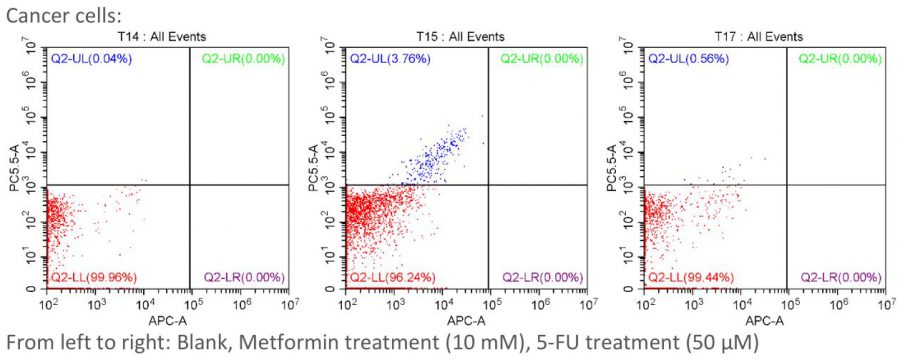
这是第一次流式细胞术的结果,加药和不加药好像真没什么区别😅
对了好像得普及一下这图怎么看,,横轴是膜联蛋白V的信号,纵轴是PI的信号。所以左下角:都是阴,活细胞;右下角:膜联蛋白V阳 PI阴,凋亡早期;右上角:都是阳,凋亡晚期或坏死;左上角:膜联蛋白V阴 PI阳,坏死。
结果这次三组,活细胞的比例分别是99.96%,96.24%,99.44%,这TM有个鬼的区别啊啊啊🙂
也许是实验哪步出问题了,或者药物处理的时间不够长?看来加药还是得多参考参考MTS的结果,之后真得试试48和72小时的了。。。这次就当熟悉实验流程了。
第三周经过一番整顿,吸取经验,准备大干一场😏 (这话怎么听着有点熟悉)。于是——我准备了个计划——
周一:准备三组MTS,分别24,48,72小时;
周二:得到24小时MTS数据,准备一组48小时流式细胞术;
周三:得到48小时MTS数据;
周四:得到72小时MTS数据,做48小时组流式细胞术
周五:准备一组72小时流式细胞术
……
下周一:做72小时组流式细胞术
这次这么一套缜密的规划肯定能大干一场嘿嘿😏(其实一点都不缜密,当时同组的一起订了周四用流式细胞仪,不得不周二就准备48小时的那组,不然应该周三出48小时MTS数据再做的啊😓

Microplate reader啊,拜托给个好数据啊🙏
周一要连续准备三组MTS,这次我重新设计了实验,对药的溶剂和体积做出调整。我采用最最最保险的溶剂——细胞培养基。。之前还整那么多干啥,用培养基直接溶药不就是最保险的吗😎 还不用多加一组对照。(这么操作缺点就是怕培养基对药物的溶解度不够,但我后来算了算理论上是够的~
这次我二甲双胍设置了6个浓度10mM,5mM,50μM,25μM,12.5μM,6.25μM;5-FU我设置了5个浓度5mM,50μM,25μM,12.5μM,6.25μM;然后再加一个空白对照,刚好一行12个;然后癌细胞HT-29和正常细胞CAL-1都做。嘿嘿,为期四天的大工程启动啦!
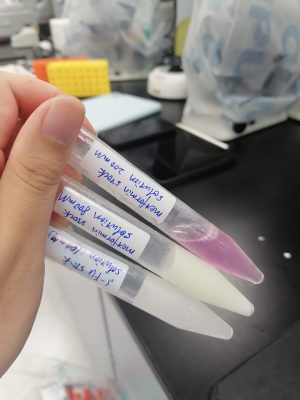
这是我当时溶药溶出来的高浓度原液(stock solution),左边两管是用DMSO溶的,放-20℃给冻住了🧊,右边一管是用培养基溶的。
我加药时都是从这原液稀释到相应浓度再加的。
为了讲清楚关于第三周MTS的大工程,我做了张表格,如下图所示。。即为具体96孔板上不同细胞不同药物不同时间如何如何安排接种的,当然每组实验都duplicate了,所以一共相当于用了48×3=144个孔。

我就先讲讲这一周所得的MTS数据,后面再讲流式细胞术的数据吧
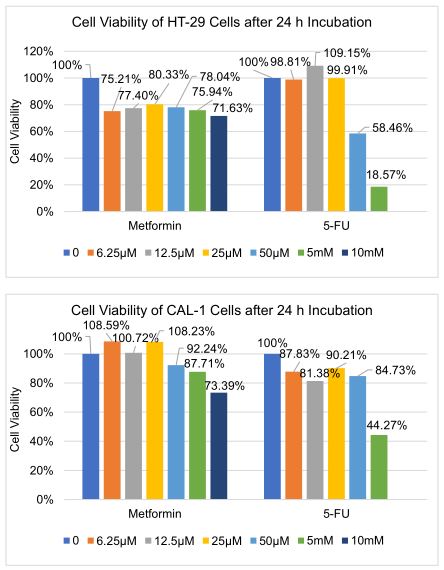
周二的时候我便得到了第一组的24小时MTS的数据,如右图所示。
二甲双胍的数据有点奇怪。在癌细胞这好像不同浓度都是存活百分之七八十,这数据真的是有些太奇怪了😕 我怀疑这里有一定程度的污染(Contamination)。。培养瓶里的细胞好像没啥事,应该是在96孔板上被轻微污染到了,导致不同浓度下都死得很平均☹️ 不过我还是打算看看后面48小时和72小时的数据怎么样。至于在正常细胞的数据就比较正常一些😊 细胞存活率随药浓度升高而降低,在低浓度下几乎就不杀细胞了。
5-FU的数据直接证明了高浓度5-FU对细胞的杀伤力,在5mM时癌细胞甚至死到剩18.57%,简直是片甲不留啊😅 但低浓度的5-FU效果好像就没有那么明显,甚至正常细胞还好像死了那么多一点😓
总的来说,24小时这组数据虽然有些收获,还是存在些问题的,尤其是二甲双胍对癌细胞的实验组中,不过还是看看后面48小时和72小时的数据再做进一步打算。
持续更新… To be continue…
想提前剧透的可先行下载论文和答辩ppt:论文Dissertation 答辩Presentation
